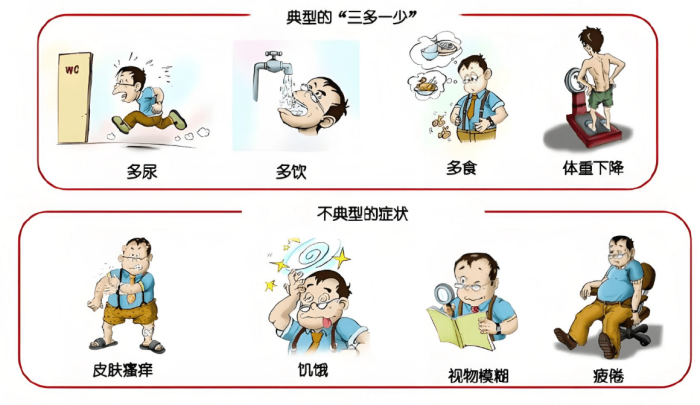
胰島素是什麼? 本文完整解析胰島素作用與危害、阻抗原因及改善方法,介紹胰島素種類、注射部位與空針使用技巧。從胰島素分泌不足到失調問題,提供藥物選擇與指數檢測指南,幫助您正確認識胰島素注射與治療關鍵!
目錄
一、胰島素概述
胰島素的基本定義與生理功能
胰島素是由胰腺β細胞分泌的蛋白質激素,分子量約5808道爾頓,由51個胺基酸組成。作為人體唯一具有降血糖作用的激素,其主要生理功能包括促進葡萄糖轉運蛋白GLUT4的轉位,增加肌肉與脂肪組織對葡萄糖的攝取;抑制肝醣分解與糖質新生;促進蛋白質合成與脂肪儲存。這種多效性調節使胰島素成為維持代謝平衡的核心物質。
胰島素在血糖調節中的核心作用
正常生理狀態下,進食後血糖升高會刺激胰島素呈雙相分泌:第一相在5-10分鐘內快速釋放儲存顆粒,第二相持續分泌新合成胰島素。這種精確調控使餐後血糖維持在4.4-7.8 mmol/L的理想範圍。當血糖低於4.0 mmol/L時,胰島素分泌幾乎完全抑制,同時升糖素分泌增加,形成完美的負反饋迴路。
胰島素發現的歷史背景
1921年加拿大外科醫師Banting與Best成功從狗胰腺提取胰島素,1922年首例糖尿病患者獲得治療,這項突破使原本致命的糖尿病成為可控制的慢性病。早期使用的牛胰島素因結構差異易產生抗體,1982年基因重組人胰島素問世,1996年第一代胰島素類似物上市,標誌著糖尿病治療進入精準醫療時代。
二、胰島素阻抗
胰島素阻抗的病理機制
當標的組織對生理濃度胰島素反應降低時即產生阻抗,其分子機制包括胰島素受體底物(IRS)絲胺酸磷酸化異常、脂肪細胞釋放游離脂肪酸過多、慢性發炎因子(如TNF-α)干擾訊號傳導等。肌肉組織攝取葡萄糖能力下降50%即達診斷標準,此時胰腺需分泌3-5倍胰島素才能維持血糖穩定。
細胞層面的葡萄糖吸收障礙
在分子層面,胰島素受體自體磷酸化減少導致PI3K路徑活化不足,GLUT4轉位至細胞膜數量下降。電子顯微鏡觀察顯示,阻抗患者的肌肉細胞膜GLUT4密度僅為正常人的30%-40%,且內質網壓力反應增強,進一步惡化細胞內葡萄糖代謝。
與代謝症候群的關聯性
根據IDF標準,符合中心性肥胖(腰圍男≥90cm、女≥80cm)加以下任兩項:高三酸甘油脂(≥150mg/dL)、低HDL(男
三、胰島素阻抗的原因
胰島素阻抗的原因:遺傳性因素與家族病史
全基因組關聯研究(GWAS)已發現超過100個風險基因位點,其中PPARG、TCF7L2、IRS1等基因變異可使胰島素敏感性下降15%-30%。若雙親均有第二型糖尿病,子女患病風險達40%,且多在40歲前發病。
胰島素阻抗的原因:肥胖與脂肪組織異常分泌
內臟脂肪超過臨界值(男性≥130cm²、女性≥110cm²)時,脂肪細胞過度分泌瘦素(leptin)、抵抗素(resistin),同時脂解作用釋放游離脂肪酸,在肌肉與肝臟形成脂質堆積,透過PKC-θ途徑干擾胰島素訊號傳導。
胰島素阻抗的原因:慢性發炎反應的影響
C反應蛋白(CRP)>3mg/L表示低度系統性發炎,此狀態下單核細胞浸潤脂肪組織,分泌IL-6、TNF-α等細胞激素,誘導SOCS3蛋白表達,加速IRS-1降解。臨床觀察顯示,牙周病、睡眠呼吸中止症患者胰島素阻抗程度較嚴重。
胰島素阻抗的原因:荷爾蒙失調(如皮質醇過高)
庫欣氏症候群患者80%伴隨糖耐量異常,因皮質醇促進蛋白質分解、增加肝糖輸出,並拮抗胰島素作用。其他如生長激素過多(肢端肥大症)、甲狀腺功能亢進等內分泌疾病,均可能引發次發性糖尿病。
四、胰島素阻抗指數
胰島素阻抗指數:HOMA-IR指數的計算與臨床意義
穩態模型評估公式:空腹胰島素(μU/mL)×空腹血糖(mmol/L)÷22.5。亞洲人群切點值通常設定為2.0,超過2.5即明確存在胰島素阻抗。研究顯示HOMA-IR每增加1單位,心血管事件風險上升17%。
胰島素阻抗指數:定量胰島素敏感性檢測方法
高胰島素正血糖鉗夾試驗(hyperinsulinemic-euglycemic clamp)被視為黃金標準,透過恆定輸注胰島素(40mU/m²/min)與變動葡萄糖輸注率(M值)來量化組織敏感度。但因操作複雜,臨床多改用簡化版胰島素抑制試驗。
胰島素阻抗指數:OGTT試驗在診斷中的應用
口服75克葡萄糖後,同時檢測0、30、60、120分鐘的血糖與胰島素曲線。胰島素分泌高峰應在30-60分鐘出現,若延遲至120分鐘且總分泌量增加,提示明顯阻抗。計算Matsuda指數可綜合評估肝臟與周邊組織敏感性。
五、胰島素分泌不足
胰島素分泌不足:第一型糖尿病的自體免疫破壞機制
約90%患者可檢測到抗GAD65、IA-2或胰島細胞抗體,CD8+ T細胞浸潤胰腺導致β細胞選擇性破壞。殘存β細胞通常少於10%,C肽濃度
胰島素分泌不足:第二型糖尿病β細胞功能衰退
UKPDS研究顯示確診時β細胞功能已喪失50%,每年以4%-6%速度衰退。屍檢發現胰島澱粉樣蛋白(IAPP)沉積是特徵性病理變化,可導致β細胞凋亡。近年發現胰高血糖素樣肽-1(GLP-1)分泌減少也是早期缺陷之一。
胰島素分泌不足:遺傳性糖尿病(如MODY)的特殊案例
青少年的成人型糖尿病(MODY)佔所有糖尿病1%-2%,目前確認11種亞型。最常見的MODY2(GCK基因突變)表現為輕度空腹高血糖但併發症少;MODY3(HNF1α突變)對磺醯脲類藥物極為敏感,需注意嚴重低血糖風險。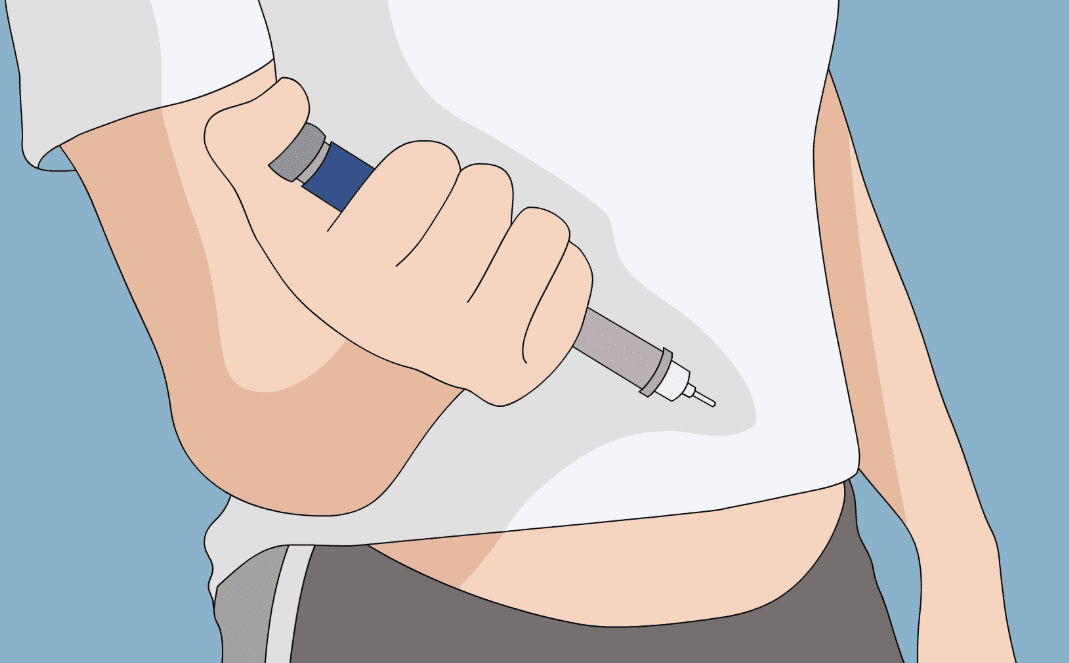
六、胰島素失調
胰島素失調:餐後高胰島素血症的病理表現
阻抗早期階段,β細胞代償性分泌增加導致餐後胰島素峰值超過100μU/mL(正常人
胰島素失調:黎明現象與Somogyi效應的區別
黎明現象指清晨4-8點因生長激素分泌增加引起的生理性血糖上升;Somogyi效應則是夜間低血糖(常發生在凌晨2-3點)後的代償性高血糖。兩者鑑別需依靠連續血糖監測,治療策略截然不同。
胰島素失調:胰島素脈衝式分泌異常
健康人胰島素呈每5-15分鐘一次的脈衝分泌,振幅約50-100pmol/L。第二型糖尿病患者這種脈衝節律變得不規則,基礎分泌比例增加而餐後第一相分泌消失,導致血糖波動加劇。
七、胰島素種類介紹
胰島素種類介紹1.速效型胰島素(Lispro, Aspart)
透過反轉B28-29胺基酸序列或引入帶負電取代基,減少六聚體形成速度。皮下注射後5-15分鐘起效,30-90分鐘達峰,持續3-5小時。最適合作為餐時胰島素使用,需注意注射後立即進食,避免延誤導致低血糖。
胰島素種類介紹2.短效型胰島素(Regular Insulin)
傳統可溶性胰島素,注射後30分鐘起效,2-4小時達峰,持續6-8小時。因作用時間較長,需在餐前30分鐘注射。臨床觀察發現其降糖效果變異度達±30%,現已逐漸被類似物取代。
胰島素種類介紹3.中效型胰島素(NPH)
加入魚精蛋白使胰島素結晶延緩吸收,注射後2-4小時起效,4-10小時達峰,持續12-18小時。因有明顯峰值易導致夜間低血糖,且吸收變異度達25%-50%,需嚴格固定注射時間與部位。
胰島素種類介紹4.長效型胰島素(Glargine, Detemir)
Glargine在pH4時可溶,皮下中性環境形成微沉澱;Detemir結合白蛋白延長作用。兩者皆提供近乎無峰值的基礎胰島素替代,持續20-24小時(Detemir需每日兩次注射)。較NPH低血糖風險降低50%。
胰島素種類介紹5.預混型胰島素的臨床應用
將速效/短效與中效按固定比例(如30/70、50/50)混合,兼顧餐時與基礎需求。適合飲食規律的老年患者,但調整劑量缺乏彈性。需注意混合後藥理特性改變,例如Humalog Mix25的速效成分峰效延遲約30分鐘。
八、胰島素藥物
胰島素藥物1.動物源性胰島素的演進
1920年代使用的牛胰島素有3個胺基酸差異,豬胰島素僅差1個,免疫原性較低但仍產生抗體。1980年代高純度單組分胰島素(MC胰島素)問世,過敏反應降至5%以下,現已完全被人胰島素取代。
胰島素藥物2.基因重組人胰島素的優勢
利用大腸桿菌(如Humulin R)或酵母菌(如Novolin R)重組生產,結構與內源性胰島素完全一致。製品純度>99%,抗體生成率<1%,解決了動物胰島素的免疫問題,但藥代動力學仍需改進。
胰島素藥物3.胰島素類似物的分子改良
透過基因工程改變胺基酸序列:速效類似物(如Lispro)減少聚合;長效類似物(如Glargine)延緩吸收。臨床試驗顯示類似物較人胰島素減少嚴重低血糖30%、夜間低血糖50%,糖化血色素多降低0.3%-0.5%。
胰島素藥物4.吸入式胰島素的發展現狀
2006年Exubera因肺功能風險退市,2014年Afrezza重新上市。使用超速效配方,15分鐘達峰,適合恐針患者。但給藥劑量限制(4-48單位),需配合長效胰島素,且禁用于吸菸者或慢性肺病患者。
九、胰島素注射技術
皮下注射的解剖學基礎
胰島素應注入真皮與肌肉間的皮下脂肪層(深度約5-15mm)。腹部吸收最快且穩定(生物利用度70%-80%),大腿與臀部較慢且受運動影響。超音波研究顯示,皮膚至肌肉距離在成人腹部平均12mm(肥胖者達30mm)。
注射角度與深度的專業要求
4mm針頭可垂直注射,6-8mm需45度角或捏皮注射。注射過深至肌肉將加速吸收(Tmax提前30%-50%),增加低血糖風險;過淺至皮內可能引起疼痛與硬結。臨床調查顯示約50%患者存在不正確注射技術。
胰島素筆與傳統注射器的比較
胰島素筆具備劑量記憶、半單位調整(兒童型)、使用便利等優勢,錯誤注射劑量減少60%。但需注意不同品牌卡匣不通用,NovoPen使用3mL卡匣(100U/mL),Lilly筆使用1.5mL卡匣(100U/mL)。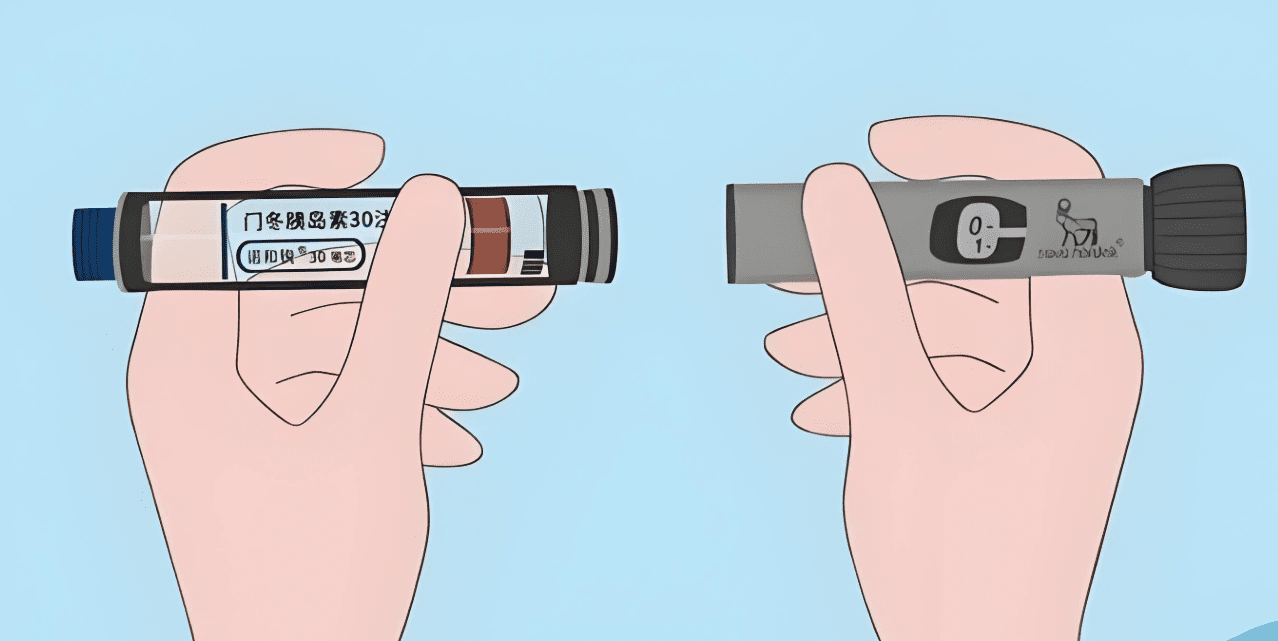
十、胰島素空針規格
胰島素空針:U-100與U-40濃度差異
國際標準U-100為100U/mL,台灣部分動物胰島素仍沿用U-40(40U/mL)。若誤用U-100空針抽取U-40胰島素,實際劑量將不足60%;反之則過量2.5倍,可能引發嚴重低血糖。
胰島素空針:針頭長度(4mm/6mm/8mm)的選擇原則
4mm針頭適用所有體型成人,6mm建議BMI>25者使用,8mm僅限極度肥胖(BMI>35)。臨床試驗顯示4mm與8mm針頭血糖控制無差異,但4mm疼痛評分降低40%、脂肪增生減少50%。
胰島素空針:超細針頭的減痛設計
最新款針頭直徑僅31G(0.25mm),配合三重磨尖技術與矽酮塗層,使穿刺阻力降低70%。視覺類比量表(VAS)評估顯示,31G比30G疼痛分數下降1.3分(滿分10分),兒童與長期注射者受益明顯。
十一、胰島素注射部位
胰島素注射部位1.腹部注射的藥物吸收特性
臍周5cm以外區域吸收速率變異最小(±10%),適合基礎胰島素。應避開疤痕、妊娠紋與疝氣部位,輪替間距至少1cm。研究顯示相同部位重複注射會使吸收率下降20%-30%,增加血糖波動。
胰島素注射部位2.大腿外側與上臂的注射要點
大腿僅限外上1/4區域,注射後30分鐘內避免運動;上臂選擇三角肌後側,需他人協助或專用注射輔助器。這兩部位吸收較腹部慢15%-20%,適合中效胰島素,但氣溫變化影響較大。
胰島素注射部位3.輪替注射預防脂肪增生
超音波研究發現,未輪替注射者60%出現脂肪增生(硬結),此區域胰島素吸收延遲50%-80%。建議採用「象限輪替法」:將腹部分四區,每周使用一區,每日注射點間隔至少1cm。
胰島素注射部位4.運動對吸收速率的影響
注射大腿後跑步可使胰島素吸收加速40%,游泳則因冷水收縮血管減慢吸收。建議運動前1-2小時避免在肢動部位注射,或預先減少10%-20%劑量,特別是中效胰島素使用者。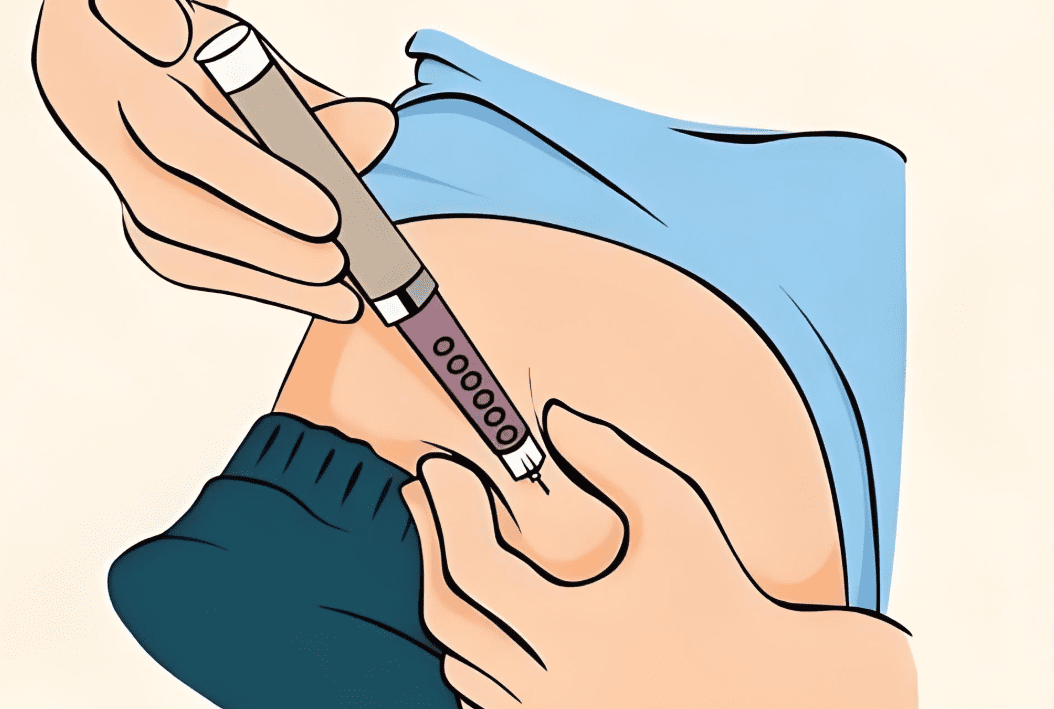
十二、胰島素的作用與危害
胰島素的作用與危害1.降血糖效應的藥理學基礎
胰島素透過活化Akt/PKB訊號路徑,促使GLUT4轉位至細胞膜,增加葡萄糖攝取。肝臟中抑制葡萄糖-6-磷酸酶,減少肝糖輸出;肌肉組織促進糖原合成;脂肪組織抑制激素敏感脂酶,降低游離脂肪酸釋放。
胰島素的作用與危害2.低血糖事件的預防與處理
血糖<3.9mmol/L即需處理,典型症狀包括冒汗、心悸、飢餓感。意識清楚者立即給予15克速醣(如120cc果汁),15分鐘未改善重複給藥。嚴重者肌肉注射升糖素1mg或靜脈推注50%葡萄糖20-50mL。
胰島素的作用與危害3.體重增加的代謝補償機制
DCCT研究顯示強化治療組平均增重4.6kg,主因尿糖減少(每日少流失300-400大卡)、防禦性進食、低血糖後過度補充。配合飲食控制與GLP-1受體促效劑可減輕此效應。
胰島素的作用與危害4.長期使用對心血管系統的影響
ORIGIN試驗證實基礎胰島素不增加心血管風險。但部分觀察性研究提示高劑量胰島素(>1.5U/kg/day)可能促進動脈硬化,機制可能與促進血管平滑肌增生、增加內皮素分泌有關。